Para entendermos melhor essa questão, é importante conhecermos o conceito de fase, bastante simples e intuitivo. Quando olhamos para uma amostra e conseguimos detectar uma porção uniforme, com características iguais em toda sua extensão, detectamos uma fase. Pense em um copo contendo água do mar. Embora saibamos que se trata de uma mistura, não percebemos qualquer diferença na amostra, ou seja, ela possui apenas uma fase.
Pense agora em um copo contendo água e óleo. Você sabe que eles não se misturam e facilmente identificamos uma porção com água e uma com óleo. Esse sistema (amostra) possui duas fases. Importante: Fases não estão ligadas ao estado físico. Você pode, como no exemplo da água e óleo, ter duas fases líquidas no mesmo sistema.
Misturas Azeotrópicas e Eutéticas
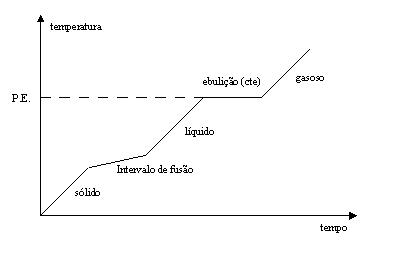
Algumas misturas apresentam características iguais às de elementos ou compostos químicos na hora da ebulição ou de fusão.
- Misturas Azeotrópicas: são misturas em que o ponto de ebulição não se altera, em temperatura constante, comportando-se como um composto químico ou um elemento. Esse tipo de mistura acontece quando o ponto de ebulição atinge o patamar.É muito comum entre líquidos. Ex.: O álcool hidratado é uma mistura azeotrópica, isso se deve porque esse álcool está misturado à água em uma proporção onde é impossível separar pela ebulição, já que a temperatura se mantém constante. PE = 78,5°C; PF = -177°C; P = 0,79g/cm³ são os pontos de fusão (PF) e ebulição (PE) do álcool.
- Misturas Eutéticas: são misturas em que o ponto de fusão dos elementos que a compõem são maiores que o da mistura eutética. Isso é muito comum em misturas entre metais. Ex.: o bronze é uma mistura de cobre com o estanho, impossível separar por fusão.
 |
Nenhum comentário:
Postar um comentário